
В настоящее время около 30-40% детей испытывают трудности при обучении в школе. Наиболее остро этот вопрос встает на начальных этапах школьного обучения...

Игры в педагогическом процессе
Тема игры в педагогическом процессе очень актуальна, игра – мощнейшая сфера «самостоятельности» человека: самовыражения, самоопределения.

Свое название педагогика получила от греческого слова "пайдагогос" (пайд — дитя, гогос — веду), которое означает детоводство или дитяведение.
Формирование знаний о кинетике химических реакций
Изменяется ли количество исходных веществ в ходе реакции?
Как изменяется число столкновений частиц при уменьшении концентрации?
Школьники делают вывод, что скорость химической реакции со временем уменьшается. Для подтверждения этого факта учащимся предлагают следующее задание: для реакции, протекающей в соответствии с уравнением
C4H9OH + HCl = C4H9Cl + HOH
Экспериментально определена концентрация одного из веществ в разные промежутки времени.
|
t, c |
0 |
79 |
158 |
316 |
632 |
|
C,моль/л |
1,67 |
1,52 |
1,30 |
1,00 |
Как изменится скорость этой реакции со временем?
Учащиеся высчитывают скорость химической реакции в первом промежутке времени, затем во втором и так далее:
W 1 = ![]() = 0,0023 моль/л • с W 2 =
= 0,0023 моль/л • с W 2 =![]() = 0,0019 моль/л • с
= 0,0019 моль/л • с
W 3 =![]() = 0,0014 моль/л • с W 4 =
= 0,0014 моль/л • с W 4 =![]() = 0,0009моль/л • с
= 0,0009моль/л • с
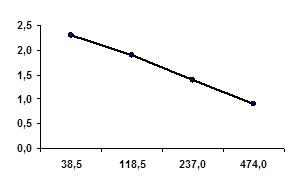 Рис 3. Зависимость скорости реакции от времени.
Рис 3. Зависимость скорости реакции от времени.
По рассчитанным значениям скорости строят график зависимости скорости реакции от времени. Использование столь малых величин вызывает затруднение у учащихся, поэтому скорость для удобства построения умножают на 103.
Важно обратить внимание учащихся на то, что скорости являются усредненными, а для более точных расчетов необходимо сокращение временного интервала. Точки в связи с этим ставятся в середине отрезков времени.
Анализируя график. Учитель еще раз формулирует главный вывод урока: с течением времени скорость химической реакции уменьшается.
Урок 2. Зависимость скорости химической реакции от внешних факторов
В начале урока идет проверка домашнего задания подобного тому, что решали на предыдущем уроке. Параллельно этому обсуждается, почему с течением времени скорость химической реакции уменьшается (уменьшается количество исходных веществ, а если реакция идет в растворе, то их концентрации). Уменьшение количества исходных веществ ведет к тому, что частицы реже сталкиваются друг с другом, поэтому и уменьшается скорость химической реакции. Получается, что скорость химической реакции зависит от концентрации исходных веществ.
Данный вывод необходимо подтвердить экспериментально: рассмотрим реакцию взаимодействия растворов тиосульфата натрия разных концентраций и соляной кислоты (0,1М). Заранее приготовленный раствор 0,1М тиосульфата натрия разбавляем: в первом стакане 2,5 мл. раствора Na2S2O3 + 5 мл. воды; во втором 5 мл. раствора Na2S2O3 + 2,5 мл. воды; в третий наливаем 7,5 мл. неразбавленного раствора Na2S2O3.
При проведении опыта один из учеников ассистирует учителю. Метроном запускают одновременно с приливанием в каждый стаканчик 2,5 мл. соляной кислоты. Момент сливания растворов считают нулевым, далее отсчитывают время от начала реакции до помутнения. Ассистент записывает на доске время протекания реакции в каждом стаканчике.
1-й стакан – 23с.
2-й стакан – 15с.
3-й стакан – 7с.
По изменению концентрации соляной кислоты вычисляем скорости реакции и чертим график:
W 1 = 0,043моль/л • с W 2 = 0,067моль/л • с W 4 = 0,143моль/л • с
 Рис. 4. Зависимость скорости реакции от концентрации.
Рис. 4. Зависимость скорости реакции от концентрации.
Вычерчивание графика отнимает время, но зато дает незаменимые навыки научного исследования, а значит, развивает мышление учащихся.Таким образом, учащиеся, анализируя график, делают вывод, что скорость химической реакции зависит от концентрации
реагирующих веществ. После этого учитель задает вопрос: будет ли влиять на скорость реакции газообразных и твердых веществ концентрация? Концентрация газа пропорциональна давлению, поэтому изменение давления (а значит и концентрации) изменяет скорость реакции. Твердые вещества под эту зависимость не попадают, так как давление на них существенного влияния не оказывает (за исключением очень больших). Таким образом, учащиеся начинают осознавать, что скоростью химических процессов можно управлять. Учитель должен сделать акцент на то, что это особенно важно для химических производств (наиболее рентабельны те производства, в основе которых лежат реакции протекающие наиболее быстро). В то же время некоторые реакции нежелательны и их скорость необходимо замедлить (например, процессы коррозии металлов). Поэтому так важно знать от чего зависит скорость химической реакции.
Понятие и структура письма как вида письменной речи
Письменная речь – одна из форм существования языка, противопоставленная устной речи. Это вторичная, более поздняя по времени возникновения форма существования языка. Если устная речь выделила человек ...
Особенности старшего школьного возраста и выбор
профессии
Общие мировоззренческие поиски заземляются и конкретизируются в жизненных планах. Жизненный план – понятие широкое. Он охватывает всю сферу личного самоопределения – моральный облик, стиль жизни, уро ...
- Главная
- Коллектив как воспитательная система
- Процесс обучения
- Развитие памяти учащихся
- Физическое воспитание учеников
- Педагогика и воспитание
- Карта сайта
- Поиск
